BioSenic se concentre sur les pathologies osseuses et la réparation des tissus pour un retour à une fonction normale. Leur défi commun : le contrôle de l'inflammation.
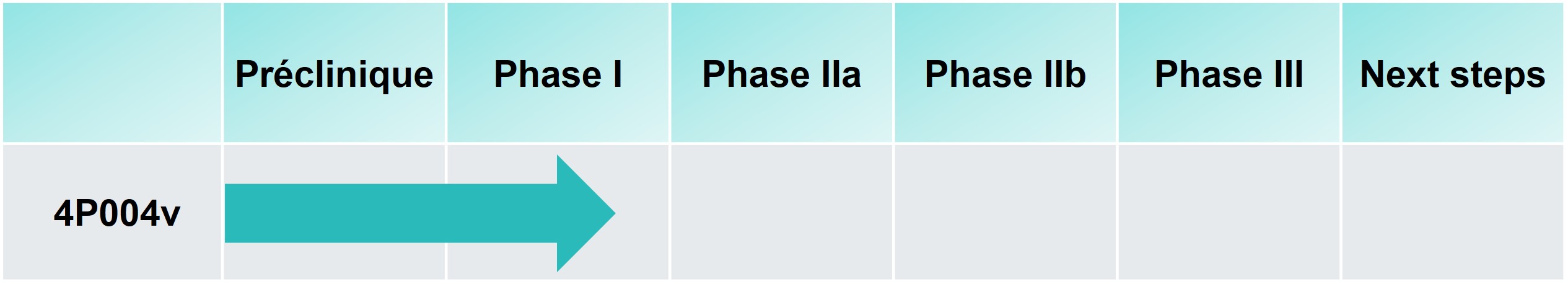
BioSenic codéveloppe, avec la société française 4Moving Biotech, 4P004v, un médicament vétérinaire pour les chiens en convalescence post‑opératoire après une réparation ligamentaire. Il s’agit de modifier l’évolution de la maladie pour une meilleure récupération post-opératoire et une qualité articulaire à long terme après une chirurgie du ligament croisé crânien (CCL). Chaque année, plus de 750 000 chiens subissent ce type de chirurgies aux États-Unis et en Europe. Les médicaments disponibles sur le marché traitant uniquement les symptômes, 4P004v pourrait répondre à un important besoin non satisfait.
4P004v
Grâce à son action unique anti-inflammatoire, anti-catabolique et régénérative, 4P004v se positionne comme le premier candidat de sa classe dans l'orthopédie vétérinaire. 4P004 est un analogue du GLP-1 conçu pour un usage intra-articulaire dans l’arthrose du genou chez l’homme. L’objectif actuel est de démontrer une preuve de concept clinique chez le chien après une réparation ligamentaire. L’étude clinique de Phase I est en cours.
- Plus
-
4Moving Biotech est une société de pointe au stade clinique, pionnière dans le domaine de la recherche sur l'arthrose (OA). Elle s’inspire des travaux du professeur Francis Berenbaum, rhumatologue de renom. Son produit unique pour la santé humaine, le 4P004, cible l'inflammation de faible intensité à l'aide d'analogues du GLP-1. Cette application innovante des analogues du GLP-1 représente une voie prometteuse vers un traitement naturel de la maladie. En intégrant une IA avancée, des données réelles et une conception innovante des essais cliniques, 4Moving Biotech optimise la sélection d'essais de Phase II à l'aide des données de 11,4 millions de patients.
Attention : 4P004v est un produit en cours d'étude et n'est pas encore disponible à la vente. Ce site web ne vise pas à fournir des conseils médicaux ni à se substituer à des soins de la part de professionnels de santé. Consultez un médecin ou un prestataire médical pour obtenir des informations sur votre diagnostic ou sur votre situation.
ALLOB
Développement passé et arrêté.
ALLOB® est un produit ostéoblastique différencié allogénique doté de propriétés régénératives pour le traitement de maladies osseuses.
Il est obtenu à partir de cellules souches de moelle osseuse cultivées ex vivo. Le terme « allogénique » signifie que les cellules sont prélevées sur un donneur sain, contrairement à l’approche « autologue » dans laquelle les cellules sont prélevées chez le patient.
ALLOB® a obtenu la désignation de médicament orphelin pour l'ostéonécrose de l'AEM en juillet 2013 et de la FDA en janvier 2014. Le produit a également reçu la désignation de médicament orphelin de la part de l'AEM et de la FDA pour l'ostéogénèse imparfaite (maladie des os de verre). ALLOB® a été classé produit issu de l'ingénierie tissulaire (non combiné) par l'AEM sous la réglementation ATMP 1394/2007EC.
Après avoir validé deux essais cliniques de Phase I/IIA de preuve de concept pour le traitement de fractures avec retard de consolidation et de procédures d'arthrodèse vertébrale, les derniers résultats obtenus lors de la Phase IIb n’ont malheureusement pas été assez concluants.
JTA-004
Développement passé et arrêté.
JTA-004 est un traitement de nouvelle génération, injectable par voie intra-articulaire, pour traiter la douleur arthrosique du genou. Développé par BioSenic, ce mélange unique breveté de protéines plasmatiques, d’acide hyaluronique – naturellement présent dans le liquide synovial de toutes les articulations – et d’un analgésique à action rapide, JTA-004 a pour objectif d’améliorer la lubrification et la protection du cartilage de l’articulation arthrosique et de soulager la douleur associée.
L’étude de Phase III de JTA-004 n’a malheureusement pas abouti à des résultats globalement assez concluants.
L’analyse post-hoc a toutefois démontré une action positive sur le sous-type d'arthrose de type 3, la douleur la plus sévère accompagnée d'inflammation. BioSenic envisage de céder ce produit si une autre société souhaite explorer les options pour le développement futur de JTA-004 pour cette application.
Pipeline clinique